Blutplättchen
Aktivierungs-spezifische Plättchenhemmer
Die Adhäsion von Plättchen an arterielle Gefäßläsionen hat eine entscheidende Bedeutung für den Verlauf und die Komplikationen der Atherosklerose, die zu akuten Koronarsyndromen (z. B. Herzinfarkten) und Schlaganfällen führen kann.
Dimeres Glykoprotein (GP) VI-Fc (Revacept) ist ein humanes Fc-Fusionsprotein, das lokal die Aktivierung von Plättchen verhindert, indem es an arterielle Läsionen bindet wie ein Gefäßpflaster. Das Medikament wurde ursprünglich in einer Zusammenarbeit mit der AG von Meinrad Gawaz (jetzt: Medizinische Klinik III der Uni Tübingen) konzipiert. In Effizienzstudien wurde dadurch die Entstehung von Blutgerinnseln (Thromben) in Arterien verhindert. Mit diesem Medikament lassen sich wichtige Nachteile bisheriger Therapien umgehen: Eine systemische Beeinflussung der allgemeinen Blutstillung findet nicht statt.
Auch dieses Medikament wurde bereits in kontrollierten Patientenstudien untersucht. Dabei wurden alle Dosen gut vertragen, keine relevanten Nebenwirkungen traten auf. Eine spezifische und dosisabhängige Hemmung der Aggregation im Blut der Probanden wurde gezeigt. Insbesondere wurde die allgemeine Blutstillung nicht beeinträchtigt: Die Blutungszeit wurde durch dimeres Glykoprotein GPVI-Fc nicht verlängert. Es traten keine Blutungskomplikationen und keine verringerte Plättchenzahl (Thrombopenie) auf. Eine klinische Phase II-Studie mit diesem Medikament untersuchte die Inzidenz von Hirninfarkten/Schlaganfällen in 158 Patienten mit symptomatischer Carotisstenose (Eudra-CT 2011-001006-10). Die Auswertung ergab günstige Effekte für die Patienten (Uphaus et al., 2022): Die Patienten hatten nach 120 mg Revacept, aber nicht 40 mg Revacept ein besseres Ergebnis bezüglich eines kombinierten Sicherheits- und Wirksamkeits-Endpunkts. Dabei war die nach Kernspin-Bildgebung (DWI-MRI) zentral ausgewertete Anzahl neuer peri-interventioneller Hirn-Infarkte in der mit 120 mg Revacept behandelten Gruppe im Vergleich zu Plazebo um 46% vermindert (10% Reduktion mit 40 mg Revacept).
(Projekt der advancecor)
Mit einem Marker versehenes GPVI-Fc kann außerdem für eine direkte Bildgebung von instabilen Plaques in Patienten verwendet werden, was in einer klinischen Studie an der Universität Tübingen untersucht wurde.
Zusätzlich wurde innerhalb des Deutschen Zentrums für Herz-Kreislauf-Forschung (DZHK) die von der Münchner „Heart Alliance“ initiierte ISAR-PLASTER-Studie zu Revacept bei koronarer Herzerkrankung durchgeführt (NCT 03312855; EudraCT 2015-000686-32). Das Protokoll der Studie wurde veröffentlicht (Schüpke et al, Thrombosis + Haemostasis 2019; 119:1539-1545). Die Teams von Prof. Adnan Kastrati vom Deutschen Herzzentrum München und von Prof. Steffen Massberg vom Klinikum Großhadern der Ludwig-Maximilians-Universität München und anderen großen Kliniken, die im DZHK zusammenarbeiten, zeigten in den geplanten 332 Patienten, dass Revacept zusätzliche, spezifische Plättchenhemmung in Aggregationsmessungen trotz bereits maximaler konventioneller Therapie erzielte. Der primäre Endpunkt von Tod oder Myokardschaden wurde nicht erreicht, möglicherweise weil technische Probleme durch das Stenting wie Seitenastverschluss nicht durch den lokalen Effekt von Revacept beeinflusst werden. Die Studie wurde in JAMA Cardiology publiziert (Mayer et al JAMA Cardiol. doi:10.1001/jamacardio.2021.0475).

Literatur
- Massberg S, Konrad I, Bültmann A, Schulz C, Münch G, Peluso M, Lorenz M, Schneider S, Besta F, Müller I, Hu B, Langer H, Kremmer E, Rudelius M, Heinzmann U, Ungerer M, Gawaz M. Soluble glycoprotein VI dimer inhibits platelet adhesion and aggregation to the injured vessel wall in vivo. FASEB J. 2004;18(2):397-9
- Bültmann A, Herdeg C, Li Z, Münch G, Baumgartner C, Langer H, Kremmer E, Geisler T, May A, Ungerer M, Gawaz M. Local delivery of soluble platelet collagen receptor glycoprotein VI inhibits thrombus formation in vivo. Thromb Haemost 2006: 95:763-766
- Bültmann A, Li Z, Wagner S, Peluso M, Schönberger T, Weis C, Konrad I, Stellos K, Massberg S, Nieswandt B, Gawaz M, Ungerer M, Münch G. Impact of glycoprotein VI and platelet adhesion on atherosclerosis–a possible role of fibronectin. J Mol Cell Cardiol 2010; 49(3):532-42
- Ungerer M, Rosport K, Bültmann A, Piechatzek R, Uhland K, Schlieper P, Gawaz M, Münch G. The novel anti-platelet drug Revacept (dimeric GPVI-Fc) specifically and efficiently inhibited collagen-induced platelet aggregation without affecting general haemostasis in humans. Circulation 2011; 123: 1891-1899
- Schönberger T, Ziegler M, Borst O, Konrad I, Nieswandt B, Massberg S, Ochmann C, Jürgens T, Seizer P, Langer H, Münch G, Ungerer M, Preissner KT, Elvers M, Gawaz MP. The platelet collagen receptor GPVI-Fc reduces platelet adhesion to activated endothelium and preserves myocardial function after transient ischemia in mice. Am J Physiol (Cell Physiol) 2012; 303: C757-C766
- Bigalke B, Pohlmeyer I, Schönberger T, Griessinger CM, Ungerer M, Botnar RM, Pichler BJ, Gawaz M. Imaging of injured and atherosclerotic arteries in mice using fluorescence-labeled glycoprotein VI-Fc. Eur J Radiol 2011; 79(2):e63-9
- Göbel S, Li ZM, Vogelmann J, Holthoff HP, Degen H, Hermann DM, Gawaz M, Ungerer M, Münch G. The GPVI-Fc fusion protein Revacept improves cerebral infarct volume and functional outcome in stroke. PLOS One 2013; 8(7):e66960; doi 10.1371/journal.pone.0066960
- Ungerer M, Li ZM, Baumgartner C, Göbel S, Vogelmann J, Holthoff HP, Bültmann A, Gawaz M, Münch G. The GPVI – Fc fusion protein Revacept reduces thrombus formation and improves vascular dysfunction in atherosclerosis without any impact on bleeding times. PLOS ONE 2013; 8(8):e71193; doi 10.1371/journal.pone.0071193.
- Ungerer M, Münch G. Novel antiplatelet drugs in clinical development. J Thromb Haemost 2013, 110(5):868-75.
- Bigalke B, Phinikaridou A, Andia ME, Sunassee K, Cooper MS, Schuster A, Schönberger T, Onthank D, Ungerer M, Gawaz M, Nagel E, Botnar RM. PET/CT and MR Imaging in a Murine Model of Progressive Atherosclerosis Using 64Cu-labeled Glycoprotein VI-Fc. Circulation Cardiovascular Imaging 2013;6(6):957-64
- Jamasbi J, Megens RTA, Bianchini M, Münch G, Ungerer M, Faussner A, Sherman S, Walker A, Goyal P, Jung S, Brandl R, Weber C, Lorenz R, Elia N, Farndale J, Siess W. Differential inhibition of human atherosclerotic plaque- induced platelet activation by dimeric GPVI-Fc and anti-GPVI antibodies: functional and imaging studies. J Am Coll Cardiol 2015; 65 (22): 2404-2415
- Reimann A, Li Z, Goebel S, Faßbender J, Holthoff HP, Gawaz M, Münch G, Ungerer M. Combined administration of the GPVI-Fc fusion protein Revacept with low dose thrombolysis in the treatment of stroke. Heart Int 2016, 11 (1): e10-e16.
- Mojica Muñoz AK, Jamasbi J, Uhland K, Degen H, Münch G, Ungerer M, Megens R, Weber C, Lorenz R, Brandl R, Siess W. Recombinant GPVI-Fc added to single or dual antiplatelet therapy in vitro prevents plaque-induced platelet thrombus formation. Thromb Haemost. 2017; 117(8):1651-1659
- Schüpke S, Hein-Rothweiler R, Mayer K, Janisch M, Sibbing D, Ndrepepa G, Hilz R, Laugwitz KL, Bernlochner I, Gschwendtner S, Kupka D, Gori T, Zeiher AM, Schunkert H, Massberg S, Kastrati A; ISAR-PLASTER-Trial Investigators. Revacept, a Novel Inhibitor of Platelet Adhesion, in Patients Undergoing Elective PCI-Design and Rationale of the Randomized ISAR-PLASTER Trial. Thromb Haemost. 2019;119(9):1539-1545
- Mayer K, Hein-Rothweiler R, Schüpke S, Janisch M, Bernlochner I et al. Efficacy and Safety of Revacept, a Novel Lesion-Directed Competitive Antagonist to Platelet Glycoprotein VI, in Patients Undergoing Elective Percutaneous Coronary Intervention for Stable Ischemic Heart Disease. JAMA Cardiol. 2021;6(7):753-761; doi:10.1001/jamacardio.2021.0475
- Uphaus T, Richards T, Weimar C, Neugebauer H, Poli S, Weissenborn K, Imray C, Michalski D, Rashid H, Loftus I, Rummey C, Ritter M, Hauser TK, Münch G, Gröschel K, Poppert H. Revacept, an Inhibitor of Platelet Adhesion in Symptomatic Carotid Stenosis: A Multicenter Randomized Phase II Trial. Stroke. 2022: online ahead of print; STROKEAHA121037006. doi: 10.1161/STROKEAHA.121.037006
Plättchen-hemmende Antikörper
Die Adhäsion von Plättchen kann aber auch komplementär durch entsprechende Antikörper gehemmt werden, die spezifisch Glykoprotein VI – abhängige Signalwege blockieren.
Solche monoklonalen Antikörper wurden in einer Zusammenarbeit mit der AG von Meinrad Gawaz (jetzt: Medizinische Klinik III der Uni Tübingen) und Frau Dr. Kremmer vom Helmholtz Zentrum München konzipiert. In einer Kooperation gelang die Identifizierung von voll humanen Fab-Antikörper-Fragmenten.
In Effizienzstudien wurde dadurch die Entstehung von Blutgerinnseln (Thromben) in Arterien verhindert. Auch mit diesen Antikörpern findet keine systemische Beeinflussung der allgemeinen Blutstillung statt.
Auch diese Antikörper einschließlich voll humaner Varianten wurden bereits in präklinischen Versuchen auf ihre Sicherheit überprüft. Die AG von Prof. Siess vom IPEK München untersuchte außerdem ihre Wirksamkeit unter Verwendung von menschlichem Plaquematerial und Perfusion von menschlichem Blut.
Die Ergebnisse sind in einer Publikation im Journal of the American College of Cardiology aufgeführt: http://www.sciencedirect.com/science/article/pii/S0735109715018471
Eine Abwägung des Für und Wider der anti-GPVI-Antikörper versus Glykoprotein VI-Fusionsproteinen findet sich unter anderem in einem Editorial von Kleiman und Kolandaivelu. Expanding the Roster : Developing New Inhibitors of Intravascular Thrombosis. J Am Coll Cardiol 2015; 65 (22): 2416 – 2419.
Fusionsproteine mit GPVI-Fc
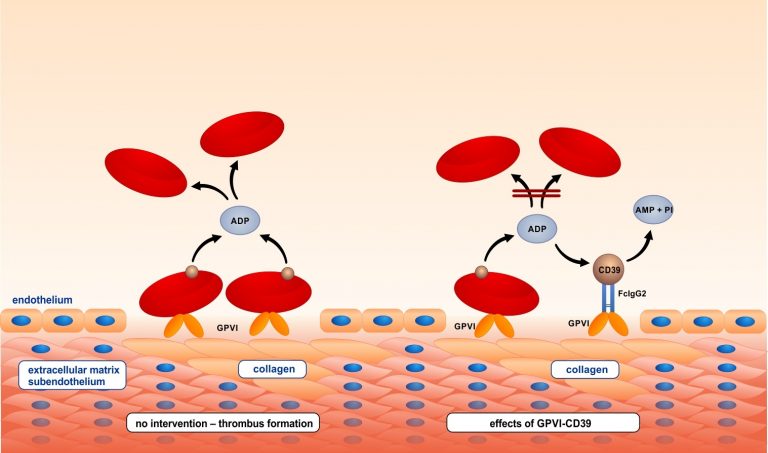
Neue Glykoprotein VI (GPVI)-Fusionsproteine mit CD39, d. h. einem Enzym, das die lokale Adenosin-Diphosphat (ADP)-Akkumulation hemmt, wurden konzipiert und exprimiert. GPVI- CD39 steigert die anti-thrombotische Wirkung im Vergleich zu reiner GPVI-Hemmung, z. B. in Flussprofilen über menschlichem Plaquematerial aus Operationen der Halsschlagader.