Projekte: Diagnostik und Therapeutische Prinzipien
G-Protein-gekoppelte Rezeptoren, Rezeptorkinasen und Arrestine
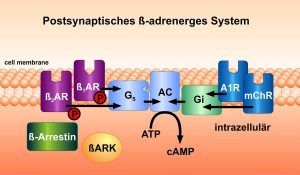
Adrenerge Rezeptoren spielen eine zentrale Rolle bei der Regulation wichtiger Organfunktionen im Körper. Katecholamine, wie z. B. Adrenalin und Noradrenalin binden an diese Rezeptoren, die in verschiedenen Organen des Körpers vorkommen. Die Rezeptoren werden über spezifische Liganden aktiviert, danach ebenso spezifisch durch Proteine aus den Familien der Rezeptorkinasen und Arrestine ab- und teilweise auf andere Signalwege umgeschaltet. Das Team hat verschiedene Moleküle entwickelt, die an diese Proteine binden und die Weiterleitung von Stimuli auf intrazelluläre Signalwege regulieren.
Außerdem wurde zunächst von der Arbeitsgruppe von W. Koch und dem Nobelpreisträger von 2012, Robert J. Lefkowitz, in dessen Arbeitsgruppe Martin Lohse mehrere Jahre arbeitete, der Gentransfer des C-terminalen Fragments „ßARKct“ der ß-adrenergen Rezeptorkinase-1 (ßARK-1, GRK-2) auf seine Wirkung auf die Funktion von Herzmuskelzellen untersucht. Es zeigte sich eine verbesserte Funktion der Zellen, und auch des ganzen Organs bei Herzinsuffizienz. Unser Team erweiterte diese Beobachtungen auf ein Gentransfer-Modell und auf das verwandte Signalprotein Phosducin. Außerdem wurden neue Transmitter und Patho-Mechanismen bei Herzinsuffizienz beschrieben. Eine spezifische Phosphorylierungsart der extrazellulär-regulierten Kinasen ERK1/2 schaltet einen schädlichen Mechanismus in Herzmuskelzellen an, der zu Hypertrophie führt.
Neue Erkenntnisse zur intrazellulären Verteilung von Second Messengern, vor allem cAMP wurden erhoben. Methoden zur optischen Messung dieser Signalaktivierung im Millisekunden-Maßstab wurden entwickelt.
Speziell wurden neue Messmethoden etabliert, um hochgenau die molekulare Aktivierung von Arrestinen zu untersuchen, und darüber z. B. Signalweg-spezifische Rezeptoragonisten („biased ligands“) zu finden.
Literatur Rezeptorpharmakologie und Signalling
- Lohse MJ, Benovic J, Codina J, Caron MG, Lefkowitz RJ. ß-Arrestin: a protein that regulates ß-adrenergic receptor function. Science 1990;248: 1547-1550
- Bauer PH, Müller S, Puzicha M, Pippig S, Obermaier B, Helmreich EJ, Lohse MJ. Phosducin is a protein kinase A-regulated G-protein regulator. Nature 1992; 358(6381): 73-76
- Ungerer M, Böhm M, Elce JS, Erdmann E, Lohse MJ. Altered expression of ß-adrenergic receptor kinase (ßARK) and ß1-adrenergic receptors in the failing human heart. Circulation 1993; 87:454-463
- Ungerer M, Parruti G, Böhm M, Puzicha M, DeBlasi A, Erdmann E, Lohse MJ Expression of ß-arrestins and ß-adrenergic receptor kinases in the failing human heart. Circulation Research 1994; 74:206-213
- Ungerer M, Kessebohm K, Kronsbein K, Lohse MJ, Richardt G. Activation of ß-adrenergic receptor kinase during myocardial ischemia. Circulation Research 1996; 79: 455-460
- Vilardaga JP, Bünemann M, Krasel C, Castro M, Lohse MJ. Measurement of the millisecond activation switch of G-protein-coupled receptors in living cells. Nature Biotechnology 2003; 21: 807-812.
- Lorenz K, Lohse MJ, Quitterer U. Protein kinase C switches the Raf kinase inhibitor from Raf-1 to GRK-2. Nature 2003; 426: 574-579
- Li Z, Laugwitz KL, Pinkernell K, Pragst I, Baumgartner C, Hoffmann E, Rosport K, Münch G, Moretti A, Humrich J, Lohse MJ, Ungerer M.
Effects of two Gbetagamma-binding proteins–N-terminally truncated phosducin and beta-adrenergic receptor kinase C terminus (ßARKct)–in heart failure. Gene Therapy 2003;10(16):1354-61 - Engelhardt S, Hein L, Dyachenkov V, Kranias EG, Isenberg G, Lohse MJ. Altered calcium handling is critically involved in the cardiotoxic effects of chronic ß-adrenergic stimulation. Circulation 2004; 109: 1154-1160
- Bünemann M, Frank M, Lohse MJ. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA 2003; 100: 16077-16082.
- Nikolaev VO, Bünemann M, Hein L, Hannawacker A, Lohse MJ. Novel single chain cAMP sensors for receptor-induced signal propagation. J. Biol. Chem 2004; 279: 37215-37218.
- Hoffmann C, Gaietta G, Bünemann M, Adams S, Oberdorff-Maass S, Behr B, Vilardaga JP, Tsien RY, Ellisman MH, Lohse MJ. A FlAsH-based FRET approach to determine G-protein coupled receptor activation in living cells. Nature Methods 2005; 2: 171-176.
- Vilardaga JP, Steinmeyer R, Harms GS, Lohse MJ. Molecular basis of inverse agonism in a G protein-coupled receptor. Nature Chem. Biol. 2005; 1: 25-28.
- Hein P, Frank M, Hoffmann C, Lohse MJ, Bünemann M. Dynamics of receptor/G protein coupling in living cells. EMBO J. 2005; 24: 4106-4114.
- Buitrago M, Lorenz K, Maass AH, Oberdorf-Maass S, Keller U, Schmitteckert EM, Ivashchenko Y, Lohse MJ, Engelhardt S. The
transcriptional repressor Nab1 is a specific regulator of pathological cardiac hypertrophy. Nature Medicine 2005; 11: 837-844. - Nikolaev VO, Bünemann M, Schmitteckert E, Lohse MJ, Engelhardt S. Cyclic AMP imaging in adult cardiac myocytes reveals far-reaching ß1-adrenergic but locally confined alpha2-adrenergic receptor-mediated signaling. Circulation Research 2006; 99: 1084-1091.
- Lorenz K, Schmitt JP, Schmitteckert EM, Lohse MJ. A new type of ERK1/2-autophosphorylation causes cardiac hypertrophy. Nature Medicine 2009; 15: 75-83
- Vilardaga JP, Nikolaev VO, Lorenz K, Ferrandon S, Zhuang Z, Lohse MJ. Conformational cross-talk between alpha 2A-adrenergic and mu-opioid receptors controls cell signaling. Nature Chemical Biology 2008; 4: 126-131
- Calebiro D, Nikolaev VO, Gagliani MC, de Filippis T, Dees C, Tacchetti C, Persani L, Lohse MJ Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biol 2009; 7:e1000172.
- Hlavackova V, Zabel U, Frankova D, Bätz J, Hoffmann C, Prezeau L, Pin J-P, Blahos J, Lohse MJ. Sequential inter- and intra-subunit rearrangements during asymmetric activation of dimeric metabotropic glutamate receptor 1. Science Sign 2012; 5: ra59.
- Lohse MJ, Nuber S, Hofmann C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signalling. Pharm Rev. 2012; 64: 299–336.
- Calebiro D, Rieken F, Wagner J, Sungkaworn T, Zabel U, Borzi A, Cocucci E, Zürn A, Lohse MJ. Single-molecule analysis of fluorescently labeled GPCRs reveals receptor-specific complexes with distinct dynamics and organization. Proc. Natl. Acad. Sci. USA 2013; 110: 743–748.
- Emami-Nemini A, Roux T, Leblay M, Bourrier E, Lamarque L, Trinquet E, Lohse MJ Time-resolved fluorescence ligand binding for G-protein-coupled receptors. Nature Prot 2013; 8: 1307-1320.
- Lohse MJ, Calebiro D. Receptor signals come in waves. Nature 2013; 495: 457-458.
- Godbole A, Lyga S, Lohse MJ, Calebiro D. Internalized TSH receptors en route to the TGN induce local Gs-protein signaling and gene transcription. Nature Commun. 2017;8(1):443
- Sungkaworn T, Jobin ML, Burnecki K, Weron A, Lohse MJ, Calebiro D. Single-molecule imaging reveals receptor-G protein interactions at cell surface hot spots. Nature 2017; 550(7677):543-547. doi: 10.1038/nature24264.
- Grushevskyi EO, Kukaj T, Schmauder R, Bock A, Zabel U, Schwabe T, Benndorf K, Lohse MJ. Stepwise activation of a class C GPCR begins with millisecond dimer rearrangement. Proc Natl Acad Sci U S A 2019; 116(20):10150-10155. doi: 10.1073/pnas.1900261116.
- Işbilir A, Möller J, Arimont M, Bobkov V, Perpiñá-Viciano C, Hoffmann C, Inoue A, Heukers R, de Graaf C, Smit MJ, Annibale P, Lohse MJ. Advanced fluorescence microscopy reveals disruption of dynamic CXCR4 dimerization by subpocket-specific inverse agonists. Proc Natl Acad Sci U S A 2020;117(46):29144-29154. doi: 10.1073/pnas.2013319117
- Möller J, Isbilir A, Sungkaworn T, Osberg B, Karathanasis C, Sunkara V, Grushevskyi EO, Bock A, Annibale P, Heilemann M, Schütte C, Lohse MJ. Single-molecule analysis reveals agonist-specific dimer formation of µ-opioid receptors. Nat Chem Biol 2020;16(9):946-954. doi: 10.1038/s41589-020-0566-1
- Annibale P, Lohse MJ. Spatial heterogeneity in molecular brightness. Nature Methods 2020;17(3):273-275. doi: 10.1038/s41592-020-0732-0
- Bock A, Annibale P, Konrad C, Hannawacker A, Anton SE, Maiellaro I, Zabel U, Sivaramakrishnan S, Falcke M, Lohse MJ. Optical Mapping of cAMP Signaling at the Nanometer Scale. Cell 2020; 182: 1519–1530; e1–e17; doi: 10.1016/j.cell.2020.07.035
- Bathe-Peters M, Gmach P, Boltz HH, Einsiedel J, Gotthardt M, Hübner H, Gmeiner P, Lohse MJ, Annibale P. Visualization of β-adrenergic receptor dynamics and differential localization in cardiomyocytes. Proc Natl Acad Sci U S A. 2021;118(23): e2101119118. doi: 10.1073/pnas.2101119118
- Anton SE, Kayser C, Maiellaro I, Nemec K, Möller J, Koschinski A, Zaccolo M, Annibale P, Falcke M, Lohse MJ, Bock A. Receptor-associated independent cAMP nanodomains mediate spatiotemporal specificity of GPCR signaling. Cell 2022;185(7):1130-1142.e11. doi: 10.1016/j.cell.2022.02.011
Untersuchung von Signalwegen
Gentransfer in Kardiomyozyten
Ein breit angelegtes Screening-Programm in relevanten Modellen menschlicher Herz-Kreislauf-Erkrankungen ermöglichte, neue Zielproteine bei diesen Erkrankungen zu identifizieren. Dabei wurden zunächst Herzmuskelzellen (Kardiomyozyten) zur Simulation des chronischen Herzversagens, Gefäßwandzellen (v. a. vaskuläre Endothelzellen) zur Untersuchung der Atherosklerose und aus Vorläuferzellen gezüchtete Blutplättchen (Megakaryozyten und Thrombozyten) zur Erforschung von Blutgerinnseln in Arterien (Thrombose) erzeugt und verwendet.
Der Schwerpunkt lag darauf, molekulare Veränderungen in Signalwegen im Direktvergleich auf ihren Effekt auf Krankheitsparameter zu untersuchen, ohne dabei einen Schwerpunkt auf einzelne Ursachen-Hypothesen zu legen.
Nach adenoviralem oder AAV-vermittelten Gentransfer wurden bei chronischer Herzmuskelschwäche relevante Proteine direkt in Kaninchenherzen in vivo exprimiert, die an dilatativer Kardiomyopathie erkrankt waren. Die Methode erfordert keine zeitaufwändige Generation von transgenen Mauslinien und keine Kreuzungsversuche.
Der Effekt auf die krankheitsrelevanten Parameter wurde mittels Echokardiographie und intrakardialen Hämodynamik-Messungen ermittelt (Methode beschrieben in: Weig HJ, Laugwitz KL, Moretti A, Kronsbein K, Städele C, Brüning S, Seyfarth M, Brill T, Schömig A, Ungerer M. Enhanced cardiac contractility after gene transfer of V2 vasopressin receptors in vivo by ultrasound-guided injection or transcoronary delivery. Circulation. 2000; 101(13):1578-85.)
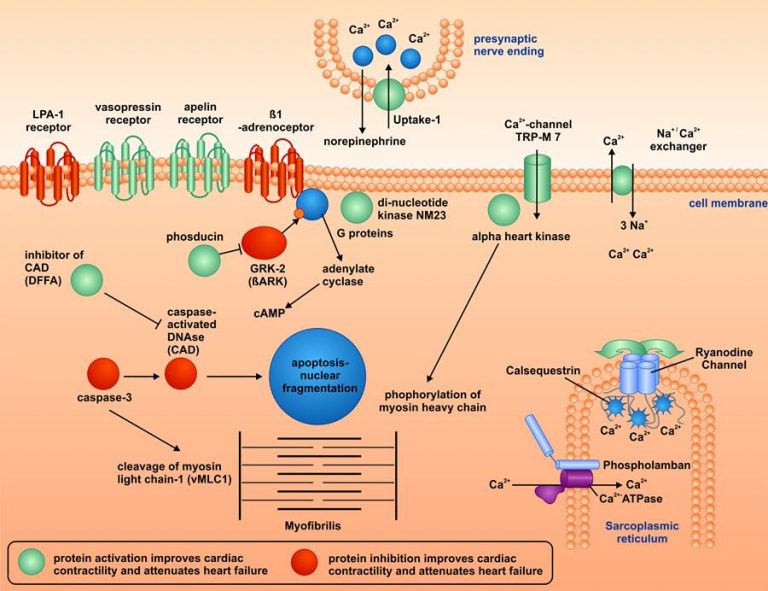
Unter einer Vielzahl von untersuchten Zielproteinen wurden dabei einige besonders relevante identifiziert. In der Abbildung sind Ergebnisse zu verschiedenen Proteinen aufgeführt, deren Aktivierung (grün markiert) oder deren Hemmung (rot markiert) direkt einen positiven Effekt auf die Herzmuskelkraft und den Krankheitsverlauf der Herzinsuffizienz hatte. Diese Proteine gehören zu den Familien der aktivierenden Rezeptoren, der Calcium-regulierenden Proteine, der Apoptose (Zelltod)-regulierenden Proteine, oder der kontraktilen Proteine. Weitere Arbeiten zeigten, dass Wirkstoffe, die an diese Proteine binden, eine noch effektivere Behandlung von Patienten mit Herzinsuffizienz ermöglichen könnten.
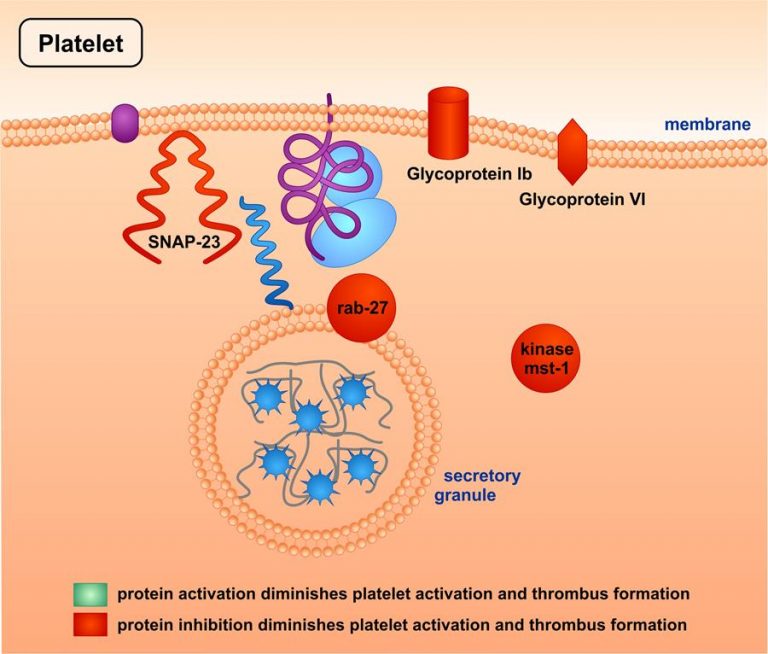
Gentransfer in Megakaryozyten/Blutplättchen
Nach retroviralem Gentransfer in Megakaryozyten wurden rekombinante Plättchen (Thrombozyten) geerntet, die für Versuche ex vivo und vivo verwendet werden konnten, z. B. Messung der Aktivierung, Aggregation und Sekretion, und der Thrombusbildung (Methode beschrieben in: Ungerer M, Peluso M, Gillitzer A, Massberg S, Schulz C, Heinzmann U, Münch G, Gawaz M. Generation of functional culture-derived platelets from CD34+ progenitor cells to study transgenes in the platelet environment. Circulation Research 2004; 95:e36-e44)
Auch dabei ergaben sich die in der Abbildung aufgeführten Ergebnisse zu verschiedenen Proteinen, deren Aktivierung (grün markiert) oder deren Hemmung (rot markiert) die Plättchen-Aktivierung und Thrombus-Bildung verminderte. Diese Proteine gehören zu den Familien der Adhäsionsrezeptoren, der Sekretions-regulierenden Proteine, oder der Serin-/Threonin-Kinasen.
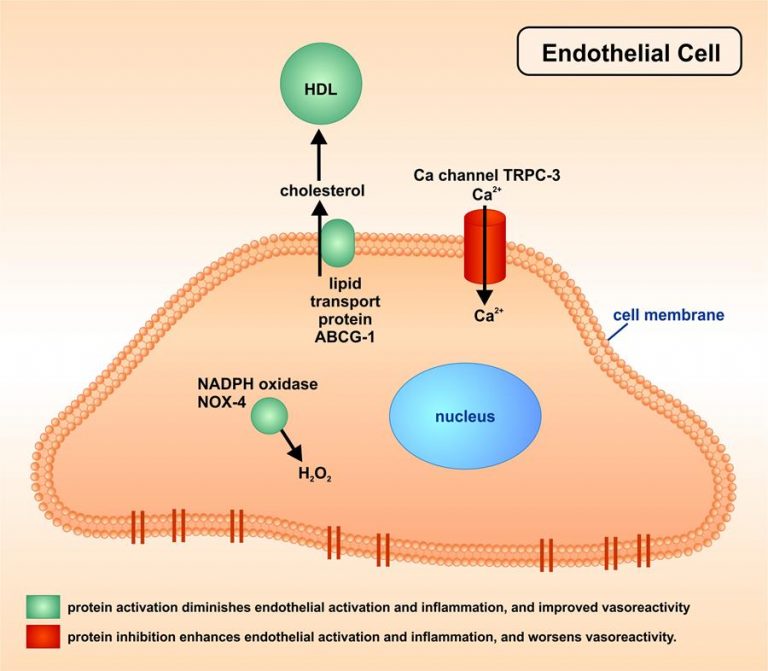
Gentransfer in das Endothel von Blutgefäßen
Nach adenoviralem Gentransfer in menschliche kultivierte Gefäß-Endothelzellen und in atherosklerotische Arterien in vivo wurden Aktivierung der Endothelzellen, und die Vasoreaktivität nach Volumen- oder parasympathischer Stimulation mittels Ultraschallmessungen in vivo ermittelt (Methode beschrieben in: Bültmann A, Herdeg C, Li Z, Münch G, Baumgartner C, Langer H, Kremmer E, Geisler T, May A, Ungerer M, Gawaz M. Local delivery of soluble platelet collagen receptor glycoprotein VI inhibits thrombus formation in vivo. Thromb Haemost 2006: 95:763-766).
Auch dabei ergaben sich die in der Abbildung aufgeführten Befunde zu verschiedenen Proteinen, deren Aktivierung (grün markiert) oder deren Hemmung (rot markiert) direkt die Endothel-Aktivierung und –Entzündung verminderte, und die vaskuläre Reaktivität verbesserte. Diese Proteine gehören zu den Familien der Cholesterin-Transport-Proteine, der Radikalen-regulierenden Proteine, oder der Kalzium-Kanäle.
Literatur zu Targets
- Li Z, Laugwitz KL, Pinkernell K, Pragst I, Baumgartner C, Hoffmann E, Rosport K, Munch G, Moretti A, Humrich J, Lohse MJ, Ungerer M. Effects of two Gbetagamma-binding proteins–N-terminally truncated phosducin and beta-adrenergic receptor kinase C terminus (ßARKct)–in heart failure. Gene Therapy 2003;10(16):1354-61
- Bölck B, Munch G, Mackenstein P, Hellmich M, Hirsch I, Reuter H, Hattebuhr N, Weig HJ, Ungerer M, Brixius K, Schwinger RH. Na+/Ca2+ Exchanger Overexpression Impairs Frequency- and Ouabain-Dependent Cell-Shortening in Adult Rat Cardiomyocytes. Am J Physiol (Heart Circ Physiol.) 2004; 287:H1435-H1445
- Münch G, Rosport K, Bültmann A, Baumgartner C, Li ZM, Laacke L, Ungerer M. Cardiac overexpression of norepinephrine uptake-1 results in marked improvement of heart failure. Circulation Research 2005, 28;97(9):928-36.
- Gillitzer A, Peluso M, Bültmann A, Münch G, Gawaz M, Ungerer M. Effects of dominant negative inhibition of SNAP-23 on platelet function. J Thromb Haemost 2008; 6:1757-1763
- Münch G, Bültmann A, Li ZM, Holthoff HP, Ullrich J, Wagner S, Ungerer M. Overexpression of ABCG1 attenuates arteriosclerosis and endothelial dysfunction in atherosclerotic rabbits. Heart Int 2012; 7: e12 – e19
- Baumgartner C, Brandl J, Münch G, Ungerer M. Rabbit models to study atherosclerosis and its complications – transgenic vascular protein expression in vivo. Progr Biophys Molec Biol 2016; 121: 131-141
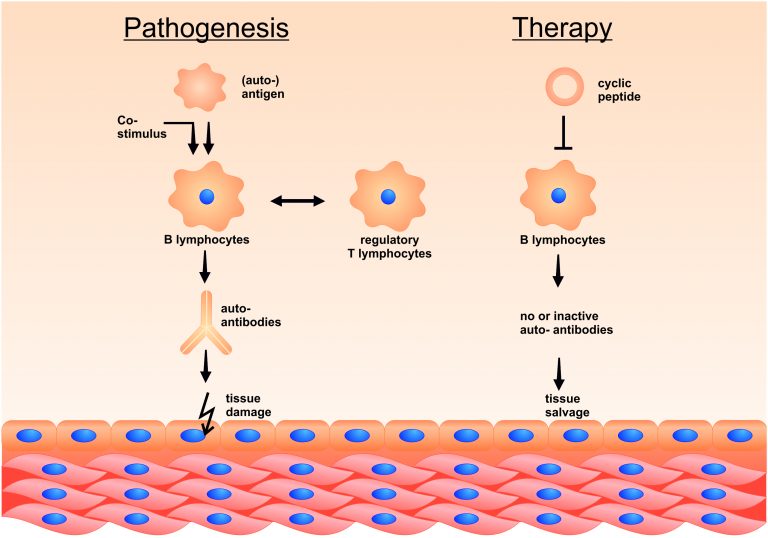
Therapie von Rezeptor-gerichteten Auto-Immun-Erkrankungen mittels „inverser Impfung“/Hyposensibilisierung
Autoimmun-Erkrankungen werden häufig von spezifischen Auto-Antikörpern verursacht, die wahrscheinlich auf der falschen Erkennung von körpereigenen Oberflächenstrukturen als „fremd“ und gefährlich beruhen, z. B. weil ein kostimulatorisches Signal gleichzeitig vom Immunsystem erkannt wird, oder weil eine Kreuz-Reaktivität mit einem krankheitserregenden Keim vorliegt.
Seit vielen Jahren werden allergische Erkrankungen erfolgreich mittels Hyposensibilisierung (=spezifischer Immuntherapie) behandelt, bei der steigende Allergendosen subkutan injiziert werden, oder (in einigen Fällen) sublingual gegeben werden können. Das führt zu einer sukzessiven Symptomverbesserung bei den betroffenen Patienten. Diese Allergenpräparationen sind aber des Öfteren nicht einheitlich, da sie aus Rohextrakten gewonnen werden.
Analog arbeitet unser Team an noch spezifischeren Impfstoffen, die die relevanten Epitope (d.h. Angriffsstellen für Autoantikörper) von Rezeptor-Allergenen in ihrer dreidimensionalen Struktur wiedergeben, und aus natürlichen Aminosäuren zusammen gesetzt sind. Diese Stoffe sind besonders rein, und deswegen auch für eine intravenöse Gabe zur Therapie von systemischen Auto-Immun-Erkrankungen geeignet.
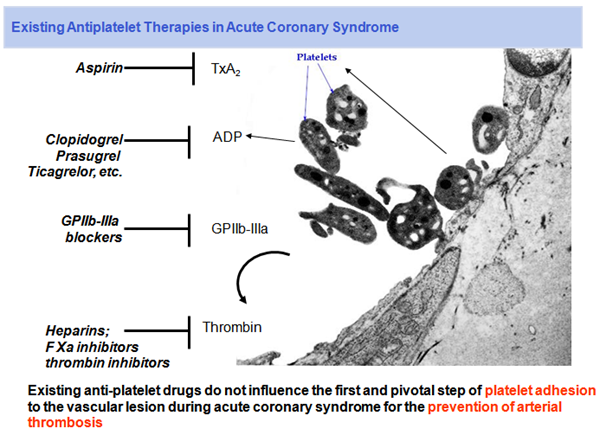
Therapie von thrombo-embolischen Erkrankungen mittels aktivierungs-spezifischer Plättchenhemmung
Blutplättchen (Thrombozyten) spielen eine zentrale Rolle bei vielen akuten und chronischen Kreislauferkrankungen. Sie sind zentral an der Bildung von arteriellen Thromben beteiligt, die weiter embolisieren können. Solche arteriellen Thromben entstehen an Endothelerosionen und rupturierenden Plaques, wo die subendotheliale Matrix dem arteriellen Blut exponiert wird. Verschiedene aktive Liganden, unter anderem Collagen, aktivieren an solchen Läsionen Plättchen.
Eine wichtige Rolle bei dieser lokalen Thrombozyten-Aggregation spielt die direkte Aktivierung der Plättchen-Proteine Glykoprotein (GP) VI und GPIb, welches von Collagen-gebundenem Von-Willebrand-Faktor aktiviert wird. Die Bildung von okkludierenden Thromben kann schließlich zu einem Myokardinfarkt oder einer Thromboembolie mit nachfolgendem ischämischem Apoplex führen.
Bisher zugelassene Medikamente wirken aber nicht nur auf solche lokal aktivierten Plättchen, sondern bewirken eine generalisierte Hemmung aller Blutplättchen im Körper, wodurch das Blutungsrisiko deutlich steigt.